Molnupiravir, medicamentul antiviral oral pentru COVID-19 produs de MSD și Ridgeback a primit aviz pozitiv de la EMA
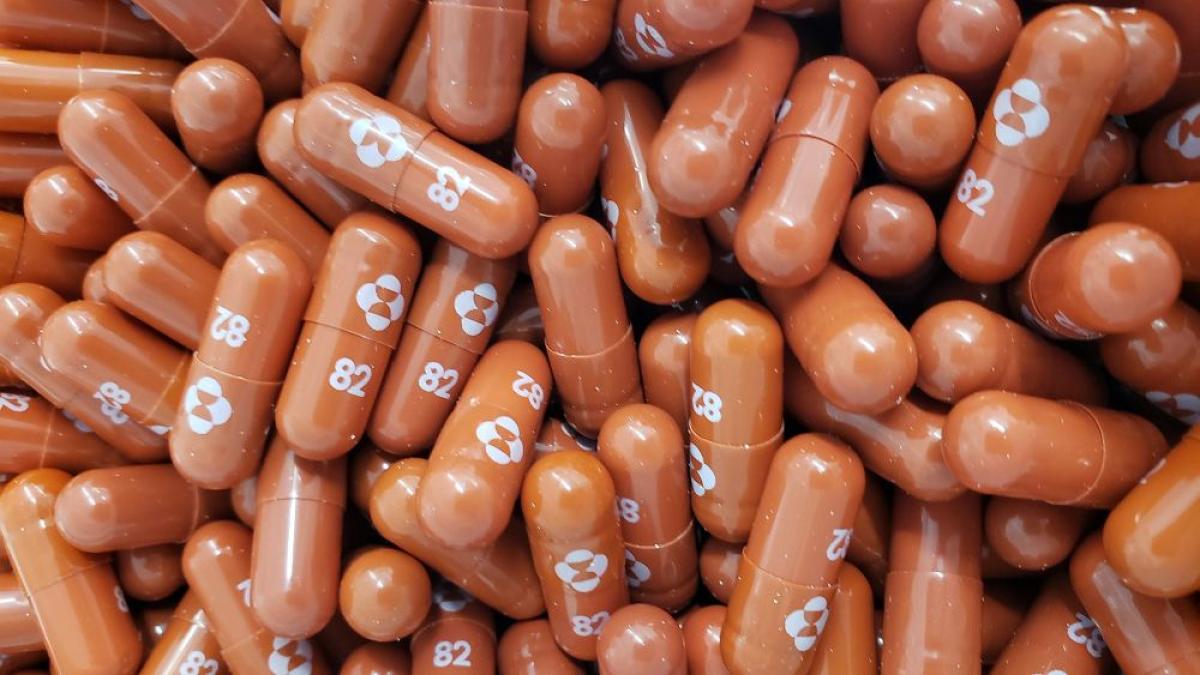 Molnupiravir este un tratament oral care previne COVID-19. Foto: MSD / Merck
Molnupiravir este un tratament oral care previne COVID-19. Foto: MSD / Merck
Avizul pozitiv al EMA (Agenția Europeană pentru Medicamente) pentru Molnupiravir (Lagevrio) a fost emis pe baza rezultatelor intermediare care arată că medicamentul antiviral oral a redus semnificativ numărul de...
MSD (denumirea comercială a Merck & Co., Inc., Kenilworth, N.J., SUA) și Ridgeback Biotherapeutics au anunțat emiterea de către Comitetul pentru medicamente de uz uman (CHMP) al Agenției Europene pentru Medicamente (EMA) a unui aviz pozitiv pentru Molnupiravir (link direct sursa informației), un medicament antiviral oral, administrat ca monoterapie pentru tratamentul COVID-19 la adulții care nu necesită oxigen suplimentar și prezintă un risc crescut de evoluție către forme severe de COVID-19.
În conformitate cu articolul 5 alineatul (3) din Regulamentul 726/2004, CHMP oferă o opinie științifică bazată pe datele disponibile preclinice și clinice, precum și cele privind calitate, ce are scopul de a ajuta autoritățile naționale să decidă asupra unei potențiale utilizări timpurii (înainte de a fi autorizat) a medicamentului. Evaluarea CHMP a avut loc în paralel cu procedura de evaluare continuă a EMA, anunțată recent de MSD. În UE și în statele membre ale Spațiului Economic European, Islanda, Liechtenstein și Norvegia, LAGEVRIO® (molnupiravir) este denumirea comercială planificată pentru molnupiravir; denumirea comercială pentru molnupiravir în alte țări nu a fost stabilită.
Efectele Molnupiravir
În Marea Britanie, Molnupiravir este în prezent primul antiviral oral autorizat pentru tratamentul formelor ușoare spre moderate de COVID-19 la adulții care au test de diagnostic pozitiv pentru SARS-CoV-2 și care au cel puțin un factor de risc pentru dezvoltarea unei forme severe de boală. Cereri de autorizare sunt în proces de evaluare sau urmează a fi depuse, inclusiv către Administraţia pentru Medicamente și Alimente (FDA) din Statele Unite pentru utilizare în situații de urgență și către Ministerul Sănătății, Muncii și Bunăstării din Japonia.
Pentru elaborarea avizului științific, EMA a revizuit datele de eficacitate preclinică și clinică și de siguranță, inclusiv rezultate pozitive ale analizei intermediare planificate a studiului clinic de fază 3 MOVe-OUT. MOVe-OUT a evaluat molnupiravir la pacienți adulți nespitalizați, cu forme ușoare până la moderate de COVID-19, cu risc crescut de evoluție către forme severe de COVID-19 și/sau de spitalizare. La analiza intermediară, tratamentul cu molnupiravir a redus semnificativ spitalizările și decesele: 14,1% (53/377) din pacienții din grupul placebo au fost internați sau au decedat, comparativ cu 7,3% (28/385) pacienți spitalizați în rândul celor care au primit molnupiravir (p=0,0012).
La analiza interimară până în ziua 29, niciun pacient tratat cu molnupiravir nu a decedat, comparativ cu opt pacienți decedați dintre cei care au au primit placebo. În cifre absolute, între grupurile cu molnupiravir și placebo a fost o diferență statistic semnificativă de 6,8%, adică o reducere cu 50% (95% CI: -11,3, -2,4; p=0,0012) a riscului de spitalizare sau de deces până în ziua 29 comparativ cu placebo. Pe datele participanților cu secvențiere virală disponibilă (aproximativ 68% dintre participanți), molnupiravir a demonstrat o eficacitate robusta pentru variantele Delta (42,4%), Mu (28,6%) și Gamma (15,8%).
Rezultate de eficacitate au fost, de asemenea, prezente la subgrupuri de pacienți, inclusiv la cei cu vârsta înaintată (> 60 de ani) și comorbidități cu risc (de exemplu, obezitate, diabet). Studiul arată că molnupiravir a fost în general bine tolerat, nefiind identificate aspecte de siguranță care să îngrijoreze. Incidența oricăror reacții adverse a fost comparabilă în grupurile molnupiravir și placebo (35,0% și respectiv 39,6%).
Rezultatele studiului clinic MOVe-OUT au fost prezentate ca noutate de ultim moment în cadrul Adunării Anuale a Societății Americane de Medicină și Igienă Tropicală (ASTMH) 2021, sâmbătă 20 noiembrie.
10 milioane de cure produse până la sfârșitul anului
Accesul global la acest medicament a fost o prioritate pentru MSD și Ridgeback încă de la începutul parteneriatului. Cele două companii au decis să ofere acces cât mai rapid la molnupiravir la nivel global printr-o abordare comprehensivă de furnizare și acces, care a presupus investiții la risc în producția a milioane de cure de tratament; stabilirea diferențiată a prețului de comercializare în funcție de capacitatea guvernelor de a finanța serviciile de sănătate; semnarea de acorduri de achiziție cu guvernele; acordarea de licență voluntară producătorilor de medicamente generice și către Medicines Patent Pool pentru ca varianta generică a molnupiravir să devină disponibilă în peste 100 de țări cu venituri mici și medii, după autorizarea de punere pe piață sau aprobarea locală.
Producție: Anticipând rezultatele studiului clinic MOVe-OUT și potențialul de a primi autorizare de punere pe piață sau aprobare, MSD a produs molnupiravir pe risc propriu și este de așteptat să producă peste 10 milioane de cure de tratament până la sfârșitul anului 2021 și încă cel puțin 20 de milioane de cure de tratament în 2022.
Cumpărat de țări bogate, produs sub licență în țările sărace
Acorduri de achiziție: MSD a semnat un acord de achiziție cu guvernul SUA, în baza căruia compania îi va furniza aproximativ 3,1 milioane cure de tratament cu molnupiravir, după autorizarea pentru utilizare în urgență sau aprobarea din partea FDA. MSD a încheiat în avans acorduri de achiziție pentru molnupiravir cu guverne din întreaga lume, inclusiv Coreea, Japonia, Marea Britanie și Statele Unite, în așteptarea autorizațiilor de punere pe piață, fiind în prezent în discuții și cu alte guverne. MSD intenționează să implementeze o strategie de stabilire a prețurilor bazată pe criteriile Băncii Mondiale privind veniturile țărilor, care reflectă capacitatea unei țări de a-și finanța răspunsul împotriva pandemiei.
Licențe voluntare: Ca parte a angajamentului său de acces la nivel global, MSD a anunțat deja că a încheiat un acord de licență voluntară cu Medicines Patent Pool pentru a permite accesul extins la molnupiravir în țările cu venituri mici și medii. În plus, MSD a anunțat deja și încheierea de acorduri de licență voluntară neexclusivă pentru molnupiravir cu producători de medicamente generice din India, pentru a accelera disponibilitatea medicamentului molnupiravir în peste 100 de țări cu venituri mici și medii, ulterior aprobării sau autorizării de urgență din partea agențiilor de reglementare locale. MSD continuă să poarte discuții pe tema măsurilor și colaborărilor suplimentare necesare pentru a accelera accesul extins și global la molnupiravir.
Despre Molnupiravir
Molnupiravir (MK-4482,EIDD-2801) este o forma investigată, administrată oral, a unui analog ribonucleozidic potent care inhibă replicarea SARS-CoV-2, agentul cauzal al COVID-19.
Molnupiravir este în curs de evaluare și ca monoterapie pentru profilaxia post-expunere în MOVe-AHEAD - un studiu de fază 3 global, multicentric, randomizat, dublu-orb, controlat cu placebo, care evaluează eficacitatea și siguranța unei cure de tratament de cinci zile cu molnupiravir în prevenirea răspândirii COVID-19 în gospodării. Studiul va înrola participanți care au cel puțin 18 ani și care locuiesc în aceeași gospodărie cu o persoană pozitivă la testul SARS-CoV-2, care are cel puțin un semn sau simptom de COVID-19 de cel mult cinci zile.
Molnupiravir a fost descoperit de Drug Innovations at Emory (DRIVE), LLC, o companie de biotehnologie non-profit deținută în totalitate de Universitatea Emory. Emory/DRIVE a primit o finanțare pentru cercetare de la Departamentul de Apărare și de la Institutul Național de Sănătate din SUA. Molnupiravir este dezvoltat de MSD în colaborare cu Ridgeback Biotherapeutics.
Despre studiul MOVe-OUT
MOVe-OUT este un studiu clinic (MK-4482-002) (NCT04575597) de fază 3, randomizat, controlat cu placebo, dublu-orb, multi-site care evaluează Molnupiravir pe pacienți adulți nespitalizați cu forme ușoare-moderate de COVID-19, confirmați printr-un test de laborator.
Pacienții înrolați în studiu au fost nevaccinați împotriva SARS-CoV-2, au avut cel puțin un factor de risc asociat evoluției nefavorabile a bolii și debutul simptomelor in intervalul de cinci zile înainte de alocarea aleatorie în studiu. Principalul obiectiv de eficacitate al MOVe-OUT este de a evalua eficacitatea molnupiravir în comparație cu placebo, măsurată prin procentul participanților care sunt spitalizați și/sau decedează din momentul randomizării până în ziua 29.
Faza 3 a studiului MOVe-OUT s-a desfășurat la nivel global, în țări precum Brazilia, Canada, Chile, Columbia, Franța, Germania, Guatemala, Mexic, Filipine, Rusia, Africa de Sud, Spania, Taiwan, Ucraina, Marea Britanie și Statele Unite.
Singurele terapii excluse au fost vaccinarea SARS-CoV-2 și terapiile anti COVID-19 (inclusiv orice anticorpi monoclonali și remdesivir) până în ziua 29. Factorii de risc cei mai frecventi ai prognosticului defavorabil al bolii au fost obezitatea, vârsta înaintată (> 60 de ani), diabetul zaharat și bolile de inimă. Variantele Delta, Gamma și Mu au avut o pondere de aproape 80% din variantele virale secvențiate la momentul analizei intermediare. Pacienții înrolati din America Latină, Europa și Africa au constituit 56%, 23% și, respectiv, 15% din populația studiului.
-
Semnul banal al demenței. Apare când vorbim26.02.2026, 16:11
-
-
Alexandru Rogobete şi directorul OMS pentru Europa, acord de colaborare26.02.2026, 13:06
-
-
Dieteticienii au numit cea mai sănătoasă brânză pentru consum zilnic26.02.2026, 11:47
Cum au fost afectați diabeticii de COVID. Ce s-a aflat abia acum
Persoanele diabetice care au avut COVID pot dezvolta sechele. Un studiu arată că aceste riscuri nu sunt doar reale, ci și mai accentuate în anumite categorii de indivizi.
Moderna retrage aprobarea vaccinului combinat gripă - COVID
Moderna retrage cererea pentru vaccinul combinat antigripal COVID.
EG.5, noua variantă COVID care îngrijorează lumea: ce trebuie să știi despre ea. Care sunt simptomele și cu ce e diferită: Dacă simțiti asta, nu respingeți imediat
Ce trebuie să știm despre varianta EG.5 a COVID-19. Ce este, care sunt simptomele și ce o diferențiază de restul variantelor COVID-19.
COVID-19, în creștere. Jurma: Creștere de cel puțin 300% a cazurilor noi și a deceselor
Pandemia de COVID-19 rămâne doar un subiect tabu în China, la 5 ani de la anunțul primului deces legat de virus
Pandemia rămâne un subiect tabu în China la cinci ani de la înregistrarea primului deces cunoscut legat de COVID-19.
De ce apar mereu noi variante COVID. Ce s-a aflat despre boală
Vaccinul anti-COVID a scăzut incidența AVC-urilor și a infarctului
Ce se întâmplă în cazul persoanelor care s-au vaccinat anti-COVID. Care este rolul critic pe care vaccinul l-a avut.
Spray-ul nazal pentru alergii care poate preveni COVID-ul, răceala și alte infecții respiratorii
Ceața cerebrală din Long COVID, descifrată. De ce milioane de oameni au pierderi de memorie
Lockdown-ul impus de COVID a accelerat îmbătrânirea creierului. Adolescenții, cei mai afectați
Impactul COVID-19 asupra Europei. România și Bulgaria, țările cu cea mai ridicată mortalitate
Ce trebuie să știi dacă faci COVID-19 vara aceasta
Ce trebuie să știi dacă faci COVID-19 în această vară.
Greșeala teribilă din pandemia de COVID care a ucis zeci de mii de oameni
Canada anulează acordul pentru fabricarea vaccinurilor Novavax Covid-19
EXCLUSIV EG.5, noua variantă de COVID, în România. Adrian Marinescu: Transmiterea se face cu ușurință
EG.5, noua variantă de COVID, face deja victime și în România. S-au înregistrat cazuri de infecții cu noua tulpină de coronavirus.
EXCLUSIV Remdesivir, tratamentul injectabil pentru COVID. Prof. dr. Simin Aysel Florescu: Administrarea se face în spitale
Acesta este unul din cele mai eficiente tratamente împotriva COVID. Tratamentul se administrează în primele zile de la debutul bolii.
EXCLUSIV Ce să faci după un test pozitiv COVID-19. Cât timp mai trebuie să te izolezi. Prof. dr. Simin Aysel Florescu explică
NB.1.8.1, noua variantă COVID care stimulează infecțiile. Care sunt simptomele
CIA afirmă că, cel mai probabil, "COVID-19 a apărut dintr-un laborator": O scurgere de la Institutul de Virologie din Wuhan
CIA afirmă că "cel mai probabil" COVID-19 a provenit dintr-un laborator.
Medicii avertizează: FLiRT, FLuQE și LB.1, variante COVID-19, se răspândesc. "Au modificări în proteina spike. Ignoră imunitatea de la vaccin sau infectarea anterioară
Medicii lansează un avertisment, deoarece noi variante ale COVID-19, FLiRT, FLuQE și LB.1, se răspândesc în lume.
EXCLUSIV Vaccinul, cheia pentru sănătate. Adrian Marinescu: E vorba de protecție individuală
Conexiune surprinzătoare între COVID-19 și regresia cancerului. COVID activează celulele anti-cancer
COVID are un impact neașteptat asupra organismului. Interacționează cu celulele canceroase.