Cele 9 medicamente cu fenspiridă retrase din Europa
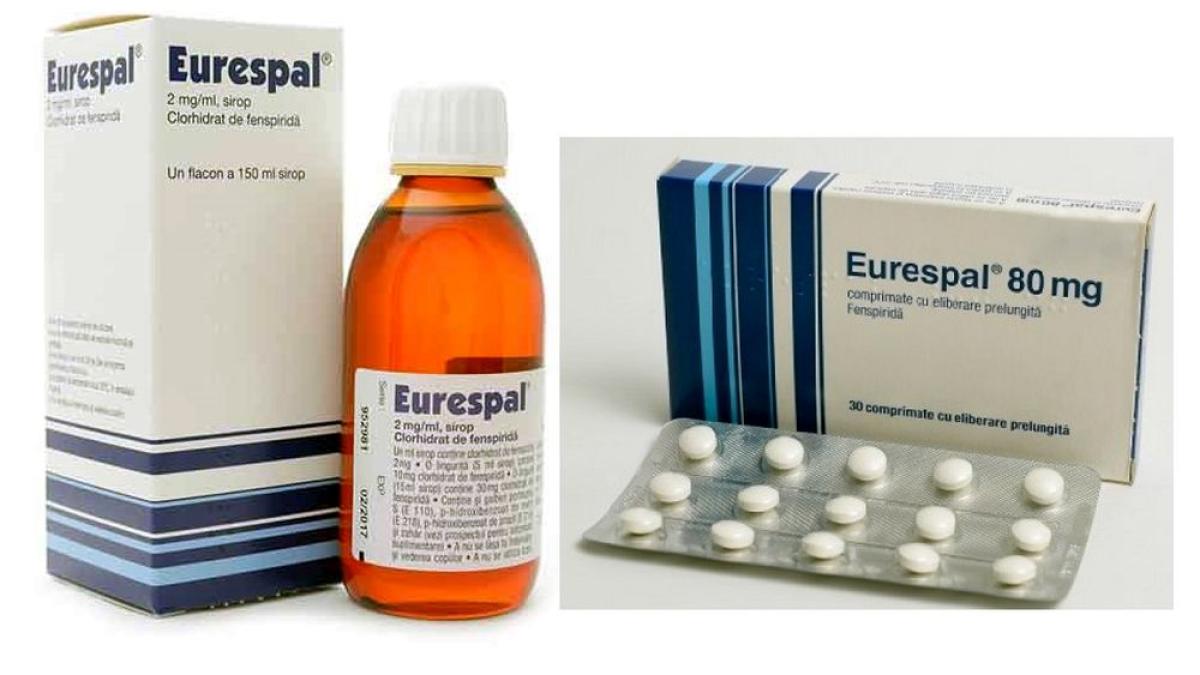 Cele două forme ale respectivului medicament au fost retrase de pe piață!
Cele două forme ale respectivului medicament au fost retrase de pe piață!
EMA – Agenția Europeană a Medicamentului a recomandat retragerea de pe piață a tuturor medicamentelor și siropurilor care conțin fenspiridă, o substanță care s-a dovedit că poate produce tulburări de...
Cele 9 produse din Uniunea Europeană care conțin fenspiridă sunt Elofen, Epistat, Eurefin, Eurespal, Fenspogal, Fosidal, Pulneo, Еуреспал și Сиресп.
Medicamentele care conțin fenspiridă se găsesc pe piață sub formă de sirop sau comprimate și se utilizează la adulți și copii peste 2 ani, fiind indicate pentru ameliorarea tusei provocate de boli pulmonare. În UE, medicamentele cu fenspiridă sunt autorizate prin procedură națională în Bulgaria, Franța, Letonia, Lituania, Polonia, Portugalia și România și se găsesc sub diferitele denumiri comerciale enumerate mai sus.
În comunicatul organizației europene se arată că „Suspendarea este recomandată ca măsură de precauție pentru protejarea pacienților pe perioada desfășurării analizei de către PRAC (Pharmacovigilance Risk Assessment Committee) a riscului de prelungire a intervalului QT și de torsada vârfurilor (manifestări anormale la nivelul activității electrice a inimii, care pot produce tulburări de ritm cardiac). La pacienții cărora li s-au administrat aceste medicamente s-au raportat cazuri de apariție a unor probleme de ritm cardiac. Pentru analiza posibilei legături dintre fenspiridă și apariția acestor probleme de ritm al inimii, s-au efectuat studii pe animale, care evidențiază potențialul fenspiridei de a prelungi intervalul QT la om.
„În momentul de față, PRAC urmează să evalueze toate dovezile avute la dispoziție și să formuleze recomandări cu privire la măsurile care se impun în întreaga UE cu privire la autorizațiile de punere pe piață pentru medicamentele care conțin fenspiridă. Odată încheiată această acțiune de reevaluare, EMA va transmite un nou comunicat, actualizând recomandările pentru pacienți și profesioniștii din domeniul sănătății", mai arată EMA.
Informații pentru pacienți
- Conform unor date de siguranță, medicamentele care conțin fenspiridă, indicate pentru ameliorarea tusei, pot provoca probleme bruște de ritm al inimii.
- Pe perioada desfășurării analizei tuturor dovezilor de către autorități, pacienților li se recomandă să nu mai utilizeze aceste medicamente.
- Pacienții sunt expuși riscului de apariție a problemelor de ritm cardiac provocate de fenspiridă numai atât timp cât utilizează medicamentele respective.
- Dacă utilizați un medicament împotriva tusei și care conține fenspiridă, adresațivă medicului sau farmacistului ca să vi se recomande alte tratamente, dacă este necesar.
- Pacienților care au nelămuriri privitoare la medicamentul utilizat li se recomandă să discute cu medicul sau cu farmacistul.
Informații pentru profesioniștii din domeniul sănătății
- Ca măsură de precauție pe perioada desfășurării acțiunii de reevaluare, profesioniștilor din domeniul sănătății li se recomandă să-și sfătuiască pacienții să nu mai utilizeze medicamentele care conțin fenspiridă.
- Măsura de suspendare provizorie a medicamentelor care conțin fenspiridă are la bază rezultatele unor studii non-clinice recente (asupra legării de canalul hERG și studii in vitro pe model animal), care au evidențiat potențialul fenspiridei de prelungire a intervalelor QT la om. Datele obținute sprijină suspiciunea anterioară referitoare la existența unei legături între fenspiridă și prelungirea intervalului QT/torsada vârfurilor la om, apărută pe baza unui număr limitat de raportări de caz.
- Având în vedere autorizarea fenspiridei numai pentru tratament simptomatic precum și gravitatea prelungirii intervalului QT, autorizația medicamentelor respective se suspendă temporar până la apariția rezultatelor unei evaluări urgente de siguranță desfășurate la nivel de UE.
- Profesioniștilor din domeniul sănătății li se va transmite o informare în scris cu privire la suspendare, după încheierea evaluării respective urmând a se furniza informații suplimentare, după caz.
-
-
-
Aspirina scade riscul de cancer de colon cu până la 50%13.12.2025, 19:06
-
Șoriciul, aperitivul de sezon pe care nu trebuie să-l ratezi13.12.2025, 18:02
-
Deficiența de B12: Cum alegi forma potrivită pentru creier și metabolism13.12.2025, 16:56
Un tip de terapie hormonală scade riscul de cancer la sân, altul îl crește
Tratamentul care distruge cancerul de vezică urinară la 82% dintre pacienți
Anticoncepționalele, efect negativ important. Duc la cancer de sân
Cine sunt pacienții care au nevoie de statine
Ce s-a descoperit în pungile de perfuzie folosite zilnic la pacienți
Cercetătorii au găsit "foarfeca genetică" ce repară ADN-ul ascuns în celule
Adio boli incurabile? Un nou instrument revoluționar de editare genetică, diferit de CRISPR, ar putea rescrie viitorul pentru mii de pacienți cu boli considerate incurabile!
Un simplu tratament de canal poate reduce riscul de infarct și diabet
Tratamentul care repară inima afectată de colesterol
Acest tratament poate inversa efectele devastatoare ale colesterolului în celulele inimii.
EMA aprobă medicamentul-cheie pentru urgențele nucleare
Ibuprofenul, pastila zilnică care ar putea proteja corpul de cancer fără să știi
Ce trebuie să știi despre tratamentul pentru tiroidă. Ce impact are asupra inimii
Anestezia locală, alternativă sigură și blândă la anestezia generală
Antidepresivele, efecte secundare
Cât ne costă medicamentele. Dr. Horațiu Moldovan: Creștere substanțială
Statinele pot încetini creșterea anevrismului de aortă abdominală
Medicament frecvent prescris pentru durere, legat de risc crescut de insuficiență cardiacă
Statinele, efect major asupra creierului
Metformin poate reduce riscul de Long COVID cu 64% la persoanele supraponderale
Medicamentul care reduce tumorile cu până la 77%
Medicamentul care reduce tumorile cu până la 77%.
Spray-ul nazal pentru alergii care poate preveni COVID-ul, răceala și alte infecții respiratorii
Medicamentul care distruge cancerul fără efecte adverse
Medicamentul minune care distruge cancerul fără efecte adverse. Blochează tumorile printr-o abordare țintită.
Nivelurile normale de vitamina B12 ar putea să nu fie suficiente pentru creier
O singură doză te scapă de depresie... 5 ani. Substanța magică anti-depresie
Un studiu arată că o singură doză de psilocibină poate avea efecte împotriva depresiei ani la rând.